高密度脂蛋白(High-density lipoprotein,HDL)参与胆固醇稳态,并可能通过与许多血浆蛋白的相互作用具有抗炎或抗菌作用。肝脏是体内合成大部分高密度脂蛋白的器官,但其实肠道也会产生部分高密度脂蛋白。但是一直以来肠道中的高密度脂蛋白与肝脏中所产生的高密度脂蛋白之间关系以及肠道中产生的高密度脂蛋白的作用尚不清楚。为此,美国华盛顿大学医学院Gwendalyn J. Randolph研究组与Yong-Hyun Han(第一作者)合作在Science发文题为Enterically derived high-density lipoprotein restrains liver injury through the portal vein,揭开了肠源性高密度脂蛋白通过门静脉抑制肝损伤的具体分子机制,为其在肝损伤以及肝脏纤维化等疾病的临床转化提供了新的思路。
高密度脂蛋白的产生需要apoA1和胆固醇转运体ABCA1。肝脏中产生了血液内大部分的高密度脂蛋白,当在肠道上皮细胞中选择性地删除编码胆固醇转运蛋白ABCA1的基因时,血浆中的高密度脂蛋白会减少25%;相反,肝特异性ABCA1缺失后高密度脂蛋白的量会降低约75%【1】。所以一直以来,肠道中所产生的高密度脂蛋白一直被认为可能是作为肝脏中高密度脂蛋白的补充来源,其本身是否具有其他的独立的功能还不得而知。门静脉会将宿主和微生物群来源的营养物质和代谢产物运送到肝脏中。通过这一途径,革兰氏阴性菌的脂多糖会在肠损伤后引发TLR4(Toll-like receptor 4)依赖性的肝脏损伤,从而导致脂肪性肝炎和肝脏纤维化等疾病的发生【2,3】。但是目前肠道门静脉抑制脂多糖介导肝损伤的机制仍不明确,因此,作者们在思考可能是由于肠道中产生的高密度脂蛋白在保护肝脏方面发挥着不可忽视的作用。
作者们发现,在小鼠和人的血液中,虽然白蛋白的总水平与在门静脉中水平是相似的,但是与高密度脂蛋白生物合成相关的apoA1的量在门静脉中低了约40%。这一现象引发了作者们的兴趣。为了确认这种减少的原因,作者们构建了光激活绿色荧光蛋白标记的apoA1内源敲入小鼠,从而可以对高密度脂蛋白的运转进行追踪。作者们发现在小肠腔内标记高密度脂蛋白后5分钟内,门静脉血液中荧光增强,但是淋巴中并没有出现。标记在肠上皮上的高密度脂蛋白首先进入门静脉,直到门静脉中的货物蛋白通过肝脏进入体循环时才在淋巴中被观察到。另外,通过分别在十二指肠、空肠以及回肠中进行apoA1光激活标记,作者们发现回肠是主要的肠源高密度脂蛋白生物合成的位点。因此,身体内的高密度脂蛋白存在两个血液循环的部分中,一个是在系统血管中由肝脏所产生的高密度脂蛋白所控制,第二个是进入门静脉血液系统中由肠道产生的高密度脂蛋白所控制。
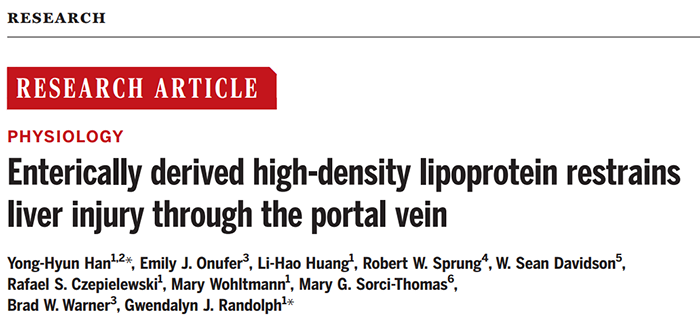
进一步地,作者们发现肠源性高密度脂蛋白主要是尺寸较小的HDL3(图1),而且会强烈地抑制肝脏中Kupffer细胞的炎症反应。与HDL2相比,HDL3会抑制脂多糖诱导的炎症基因的表达,并且是以一种TLR4依赖的方式进行的。同时作者们还发现此过程需要脂多糖结合蛋白LBP的参与。
图1 肠源性脂蛋白主要是HDL3
那么,脂多糖与高密度脂蛋白之间的结合是如何进行的呢?作者们发现脂多糖与HDL3而非HDL2有着显著地结合,并且需要LBP的参与。LBP结合到高密度脂蛋白上会促进脂多糖的隔离。因此,作者们发现高密度脂蛋白HDL3通过阻断脂多糖与肝脏Kupffer细胞的结合来抑制炎症反应,而且高密度脂蛋白HDL3结合的脂多糖也会容易被AOAH(Acyloxyacyl hydrolase)脱酰【4】进行失活,从而达到保护机体的“双保险”机制。
进一步地,为了确定高密度脂蛋白对于脂多糖的中和作用是否在体内也会对肝脏疾病进行调节,作者们使用了一种促进肝脏纤维化的小肠切除模型【5】。通过该模型,作者们发现小肠来源的高密度脂蛋白的确保护免受多种小鼠肝脏损伤模型的损伤。
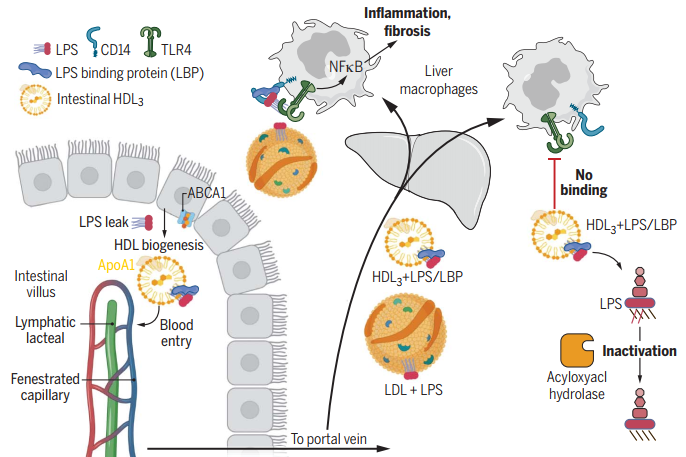
图2 工作模型
总的来说,该工作发现小肠肠上皮细胞中会产生高密度脂蛋白从而有效遮蔽脂多糖(图2),从而建立起一种疾病耐受的策略,保护肝脏免受肠源性的损伤,同时也为保护肝脏免受肠源性脂多糖泄露提供了一个新颖的药物筛选靶点。
原文链接:
https://doi.org/10.1126/science.abe6729
参考文献
1 Brunham, L. R. et al. Intestinal ABCA1 directly contributes to HDL biogenesis in vivo. The Journal of clinical investigation 116, 1052-1062, doi:10.1172/jci27352 (2006).
2 Duan, Y. et al. Bacteriophage targeting of gut bacterium attenuates alcoholic liver disease. Nature 575, 505-511, doi:10.1038/s41586-019-1742-x (2019).
3 Hritz, I. et al. The critical role of toll-like receptor (TLR) 4 in alcoholic liver disease is independent of the common TLR adapter MyD88. Hepatology (Baltimore, Md.) 48, 1224-1231, doi:10.1002/hep.22470 (2008).
4 Munford, R. S., Weiss, J. P. & Lu, M. Biochemical transformation of bacterial lipopolysaccharides by acyloxyacyl hydrolase reduces host injury and promotes recovery. The Journal of biological chemistry 295, 17842-17851, doi:10.1074/jbc.REV120.015254 (2020).
5 Courtney, C. M. & Warner, B. W. Pediatric intestinal failure-associated liver disease. Current opinion in pediatrics 29, 363-370, doi:10.1097/mop.0000000000000484 (2017).













